血脂異常是動脈粥樣硬化性心血管疾病(ASCVD)的核心危險因素。在現有他汀類藥物和PCSK9抑制劑基礎上,血管生成素樣蛋白3(ANGPTL3)作為新型降脂靶點,憑借其獨特的非低密度脂蛋白受體(LDLR)依賴途徑和多重調脂機制,為頑固性高脂血癥患者,尤其是常規治療反應不佳的純合子型家族性高膽固醇血癥(HoFH)患者提供了新的治療方向,標志著降脂藥物研發的重要進展。
常規降脂局限性
HoFH患者的臨床需求亟待滿足
純合子型家族性高膽固醇血癥(HoFH)是一種由于LDL-C分解代謝關鍵基因發生純合突變或復合性雜合突變導致的嚴重常染色體隱性遺傳病。HoFH患者自幼暴露于極高的LDL-C水平,顯著增加動脈粥樣硬化性心血管疾病(ASCVD)風險,可能在兒童、青少年或成年期發生心絞痛或心肌梗死,致死率和致殘率極高。
現有降脂藥物(如他汀類和PCSK9抑制劑)的作用機制多依賴于LDLR功能,而HoFH患者普遍存在LDLR功能缺失或缺陷,導致傳統藥物治療效果不佳。[1]因此,理論上來講,研發通過非LDLR途徑降低LDL-C的藥物對HoFH患者至關重要。
ANGPTL3抑制劑
獨特機制為HoFH患者提供救命選擇
血管生成素樣蛋白(ANGPTL)家族于2000年左右被發現。其蛋白結構與血管生成素相似,但不與血管生成素受體TIE2結合。該家族現包括8個成員(ANGPTL1-8),其中多個成員在脂質代謝、血管生成和干細胞維持中發揮作用。
血管生成素樣蛋白3(ANGPTL3)是由460個氨基酸組成的多肽,包含一個N端螺旋結構域和一個C端纖維蛋白原樣結構域。其N端區域可逆性抑制脂蛋白脂肪酶(LPL)的催化活性,從而調節血漿甘油三酯(TG)水平。ANGPTL3主要在肝臟表達,通過獨立于LDL受體介導清除的途徑調節LDL-C和TG代謝。
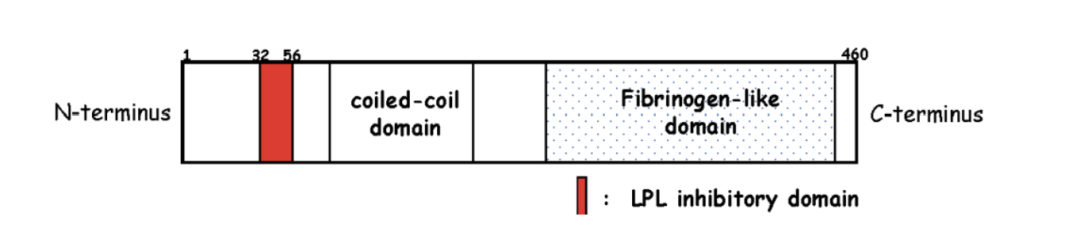
圖 ANGPTL3的結構
來源:公開資料
2002年Yoshida等的研究發現,具有肥胖、高血糖和高血脂特征的KK小鼠中,低血脂表現的KK/San小鼠幾乎不表達ANGPTL3。誘導KK/San小鼠ANGPTL3基因過表達或靜脈注射純化的ANGPTL3蛋白,可顯著提高小鼠血漿TG、總膽固醇(TC)和游離脂肪酸水平,證實了ANGPTL3基因缺失是KK/San小鼠低血脂表現的原因[2]。
后續研究揭示,ANGPTL3通過抑制LPL和內皮脂肪酶(EL)的活性調節TG水平。ANGPTL3通過其N端LPL結合基序與LPL結合,抑制其酶活性,導致血清TG濃度升高。同時,ANGPTL3抑制EL活性,可能通過VLDL受體及其他受體(如LDL受體相關蛋白)影響富含甘油三酯的脂蛋白(如極低密度脂蛋白VLDL)殘粒的清除。
ANGPTL3抑制劑的作用在于解除其對LPL和EL的抑制,增強這兩種酶的活性。因此,VLDL顆粒經歷更有效的脂解,其殘粒被肝臟、脂肪組織、肌肉和血管細胞等更高效地清除,總體上限制了LDL顆粒的形成,并降低了循環LDL-C水平。
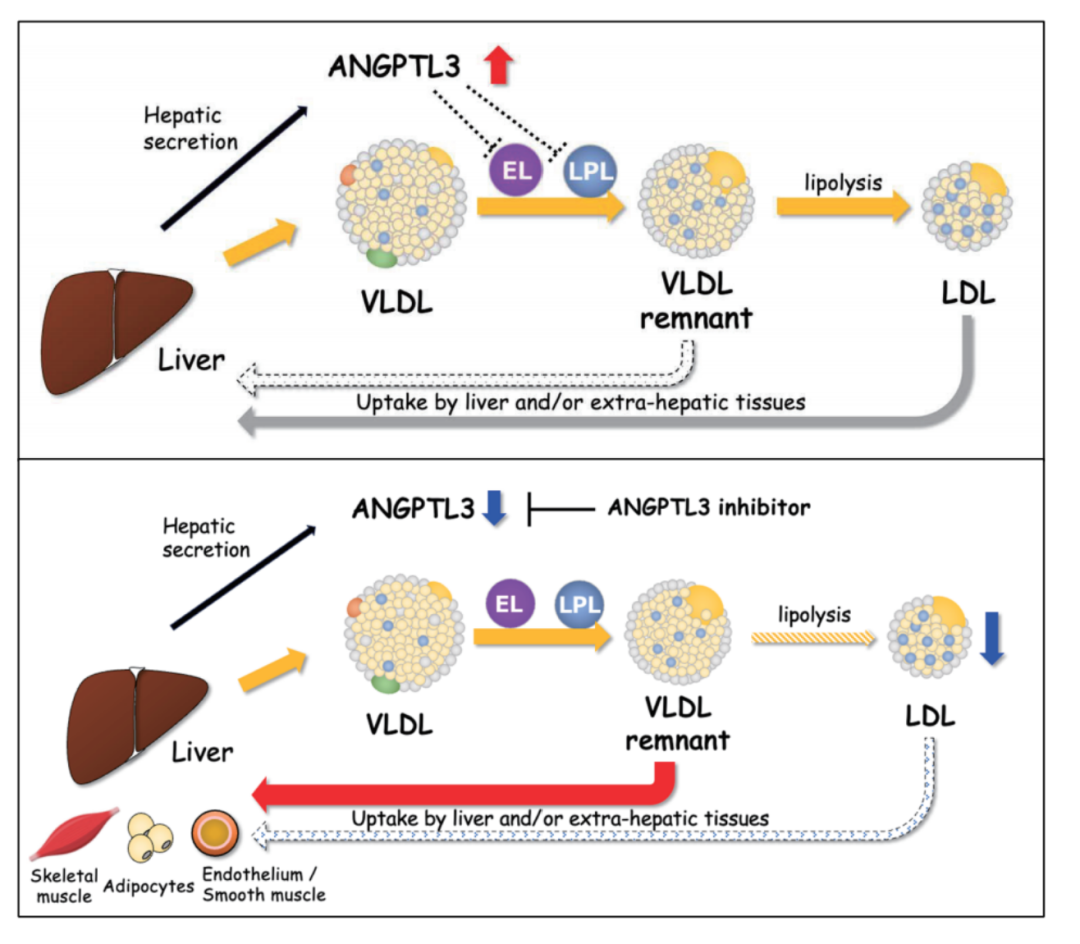
圖 ANGPTL3調節脂肪動員機制
來源:公開資料
ANGPTL3的作用機制獨立于LDL受體,這是ANGPTL3抑制劑能夠在LDLR功能缺失或缺陷的HoFH患者中有效降低LDL-C的關鍵基礎。
此外,ANGPTL3除全身性脂質調節功能外,還可促進內皮細胞粘附、遷移和血管生成,參與與動脈粥樣硬化斑塊進展及不穩定性相關的活動。ANGPTL3激活整合素信號傳導亦可刺激巨噬細胞的促炎反應,增加細胞因子產生并促進細胞內脂質積累(泡沫細胞形成),從而加速動脈粥樣硬化進程。
研發格局
靶點成藥性獲驗證,多技術路徑并行發展
根據藥智數據顯示,目前全球僅有1款ANGPTL3抑制劑獲批上市,另有11款處于不同研發階段,包括3款單克隆抗體和6款小干擾RNA(siRNA)藥物。其中,在中國市場,進展至臨床III期的ANGPTL3抑制劑有2款:恒瑞醫藥的皮下注射單抗SHR-1918和維亞臻生物的siRNA注射液VSA-003,其首發適應癥均針對HoFH。海外市場,諾和諾德和禮來等巨頭也在該靶點積極布局。
單克隆抗體:首款上市藥物領跑
依維蘇單抗(Evinacumab):由再生元制藥研發的人源抗ANGPTL3單克隆抗體,于2021年獲FDA批準用于HoFH治療,成為該靶點首個上市藥物。其通過降低TG并增加含載脂蛋白B(apoB)脂蛋白的清除率來降低LDL-C。關鍵臨床研究顯示:在HoFH患者中,依維蘇單抗可顯著降低LDL-C水平(臨床III期:治療組較安慰劑組降低49%)及TG水平(降低50%)[3]。
SHR-1918(恒瑞醫藥):國內首個進入Ⅲ期臨床的ANGPTL3靶向單抗,已于2024年9月被CDE納入突破性治療品種。I期研究顯示,健康受試者用藥后LDL-C最大降幅達46.5%-49.1%,TG最大降幅達67.4%-82.8%。II期研究表明,其在中高危ASCVD患者中可同時顯著降低LDL-C和TG水平,安全性良好[4],展現出降低殘余心血管風險的潛力。
核酸療法:siRNA藥物表現活躍
諾華開發的PCSK9靶向siRNA藥物Inclisiran于2020/2021年相繼獲EMA/FDA批準,證明了肝臟靶向siRNA策略在降脂領域的可行性,也為ANGPTL3 siRNA藥物的開發鋪平了道路。
Zodasiran(ARO-ANG3, Arrowhead Pharma):皮下給藥的合成雙鏈siRNA,靶向肝臟ANGPTL3 mRNA實現長效基因沉默,設計為每半年給藥一次。其治療混合型血脂異常的IIb期研究取得積極結果(兩次給藥顯著降低第24周TG水平),目前已進入III期臨床。
VSA-003(維亞臻生物):肝臟靶向siRNA注射液,通過降解ANGPTL3 mRNA增加LDL-C和TG清除,已于2024年1月被CDE納入突破性治療藥物品種。
BW-01(舶望制藥):基于其RADS平臺自主研發的ANGPTL3 siRNA。澳洲和中國I期試驗均顯示其良好的安全性和耐受性。2024年1月,舶望制藥與諾華達成重大合作(首付款1.85億美元,潛在總價值近42億美元),涵蓋包括ANGPTL3在內的多個RNAi項目。
反義寡核苷酸(ASO)探索遇阻:輝瑞/Ionis合作的ANGPTL3 ASO藥物Vupanorsen雖在IIb期達到主要終點,但因高劑量組觀察到肝酶升高(44.4%)及肝臟脂肪含量顯著增加(76%),其開發已被終止。
未來趨勢
多靶點和新技術齊頭并進
靶向ANGPTL3/8復合物
ANGPTL8是ANGPTL家族的另一成員,不同于ANGPTL3,ANGPTL8沒有C端的FLD。ANGPTL3的活性依賴ANGPTL8的活化,而ANGPTL8的水平受進食狀況的影響,禁食或運動狀態下,ANGPTL8表達下調,使WAT中LPL的活性減弱,循環中的TG就進入外周組織(如心臟和肌肉)被利用。ANGPTL3/8復合物會較強地抑制LPL活性,阻止脂質代謝,因此靶向ANGPTL3/8復合物成為ANGPTL降脂治療的新發展方向。
禮來的LY3475766是一款靶向ANGPTL3/8復合物的單抗,最近發布的I期臨床實驗結果顯示LY3475766單次給藥即可顯著降低多種致動脈粥樣硬化脂蛋白水平,同時升高HDL-C,且安全性良好。
CRISPR-Cas9基因編輯療法
CRISPR-Cas9基因編輯療法通過從基因層面誘導ANGPTL3基因的功能失活,通過糾正遺傳錯誤,CRISPR-Cas9治療有望對遺傳性血脂異常實現“一勞永逸”的治療,克服長期用藥的困擾。CTX310是由CRISPR Therapeutics開發一款體內基因編輯療法,包括編碼Cas9的mRNA和靶向ANGPTL3的gRNA,通過脂質納米顆粒(LNP)遞送至肝臟,通過基因敲除ANGPTL3來實現治療效果。CTX310的最新臨床I期實驗數據證明其劑量依賴性降低TG和LDL,TG峰值降低幅度高達82%,LDL峰值降低幅度高達86%,且具有良好的耐受性和安全性。
結語
ANGPTL3作為新型降脂靶點,其非LDLR依賴的作用機制為治療LDLR功能嚴重缺陷的HoFH患者提供了突破性的解決方案。全球研發格局中,單克隆抗體(如依維蘇單抗)和siRNA療法進展顯著,能有效且大幅降低HoFH患者的LDL-C與TG水平。
新興方向如靶向ANGPTL3/8復合物及CRISPR-Cas9基因編輯療法展現出獨特優勢和廣闊前景,后者更具備長效乃至“一次性”治療的潛力。
這些進展有望有效填補當前HoFH治療領域的空白,并推動降脂治療進入新的發展階段。







