過去十年,雙特異抗體的崛起就像是人類首次學會了如何建造精密的"戰術橋梁":一端牢牢抓住潛伏在人體內的癌細胞,另一端則召喚并激活我們自身的免疫戰士——T細胞,讓它們能夠跨越以往無法逾越的鴻溝,面對面與敵人進行決戰。
然而,敵人向來不會坐以待斃,治療過程中的癌細胞往往會展現出其狡猾本性,即改變表面抗原的表達模式,避開雙抗的識別,并主動構建各種"防御工事"來抵抗免疫系統的攻擊。
因此,科學家開始深入思考:能否設計出更加智能和堅固的"橋梁",讓它不僅能夠同時識別敵人的多種偽裝,還能夠招募不同類型的友軍,形成更加全面和持久的包圍攻勢?
在此驅動下,三特異抗體應運而生,成為下一代免疫療法研發的核心焦點。
從雙抗到三抗
原則上來講,三抗其實當屬于21世紀才出現的全新技術類型。
2004年,三抗技術首次被Huang等人所提出,但受限于當時的技術瓶頸,未能如愿引起行業關注。
2010年后,隨著免疫檢查點抑制劑(如PD-1)和CAR-T療法陸續獲批,腫瘤免疫治療技術逐漸趨于成熟,間接為多抗技術提供應用場景。
2022年,賽諾菲在《Nature》上連發多篇文章分享CD38/CD3/CD28三抗的研發進展,至此這一領域嘗試正式進入大眾視野。
2024年后,三抗研發明顯加速,眾多MNC與Biotech的研發熱情逐漸由單抗、雙抗向著三抗輻射。
而究其根本,之所三抗能在20余年里快速發展,一者是基礎醫學技術進步使然,二者也是雙抗臨床應用的局限性所致。
首先,如果把癌癥治療比作一場防御戰,腫瘤細胞是城里的“偽裝間諜”,而免疫細胞是我們的巡邏隊。過去的雙抗就類似于情報員,一手牽著白細胞特警隊(T細胞),一手指著嫌疑目標(HER2腫瘤細胞),使T細胞更高效的殺滅腫瘤細胞。但問題是,抓捕過程中特警隊會疲憊、會掉隊,這就導致抗腫瘤效果往往是越來越差。
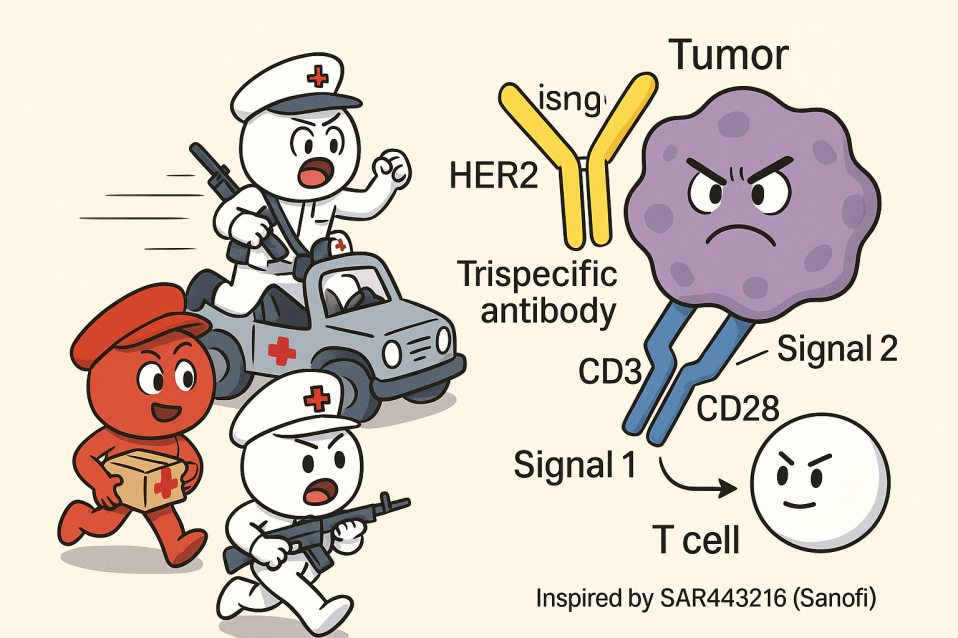
圖1:三特異T細胞激活劑SAR443216(HER2×CD3×CD28)機理
圖片來源:賽諾菲的Nature論文.doi: 10.1038/s41586-022-04439-0
而三特異性抗體則有所不同,其在雙抗的基礎上,繼續與腫瘤細胞或免疫細胞表面的另一個靶點相結合,或橋接免疫細胞并阻斷雙信號通路等作用,更有利于將藥物或免疫細胞重定向至腫瘤部位,增強結合特異性,提高靶向性,降低脫靶毒性,從而提升抗腫瘤能力。
以賽諾菲的SAR443216為例,其“三把鑰匙”的獨特機制,從本質上改變了抗腫瘤的整個故事線:
第一把鑰匙(HER2)——紅細胞搬運員送來位置地圖,精準鎖定目標大樓。
第二把鑰匙(CD3)——白細胞特警隊破門而入,開始清理現場。
第三把鑰匙(CD28)——免疫司令部派來能量補給車(協同刺激信號),讓特警隊不但能打,還能在戰斗中升級裝備,形成“免疫記憶部隊”。
更有意思的是,常被比喻成“支援兵”的 CD4+ T 細胞,在這個任務里竟然成了主攻隊,直接干掉大部分敵人,同時呼叫支援部隊釋放“火力彈”(細胞因子),形成包圍圈。這提示我們未來三抗設計需要更深入考慮免疫細胞群體間的協同作用,理解藥物真實的作用機制,可能比設計藥物本身更重要。

圖2:DF1001的AACR學術海報
圖片來源:Dragonfly官網
三抗成為“風口”的三大表現
1.全球管線數量集體爆發
近十年來,三特異性抗體(TsAb)從概念驗證快速步入臨床研究。早期的三特異性分子主要是“Trispecific Killer Engagers”(TriKE),用于在體外激活自然殺傷細胞,其核心是加入IL-15或其它細胞因子,項目停留在研究階段。
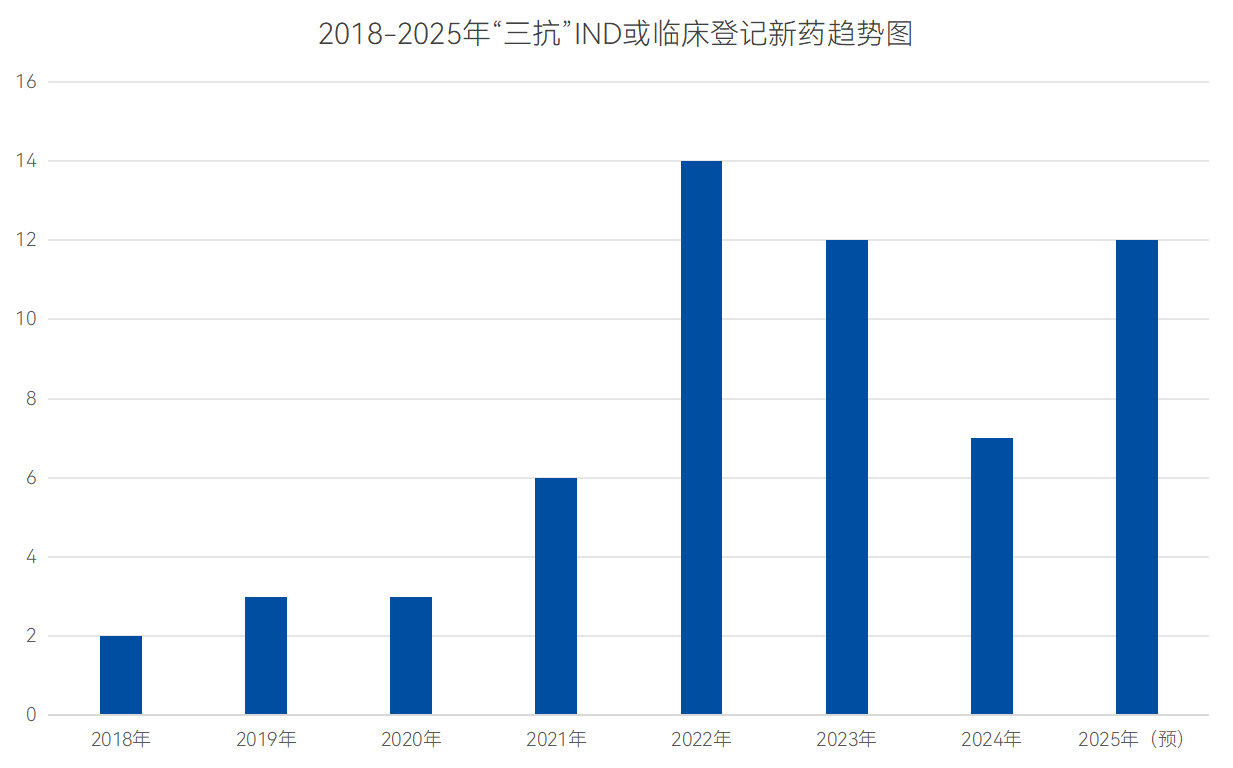
數據來源:藥智數據
后來,隨著工程化抗體平臺成熟,首個真正的三特異性T細胞激活構建體(SAR442257)于2020年5月進入 I 期臨床試驗。截止目前,全球范圍內已有超過50種三特異性抗體處于臨床試驗階段,且數量逐年上漲。
全球部分在研進度居前的三抗管線
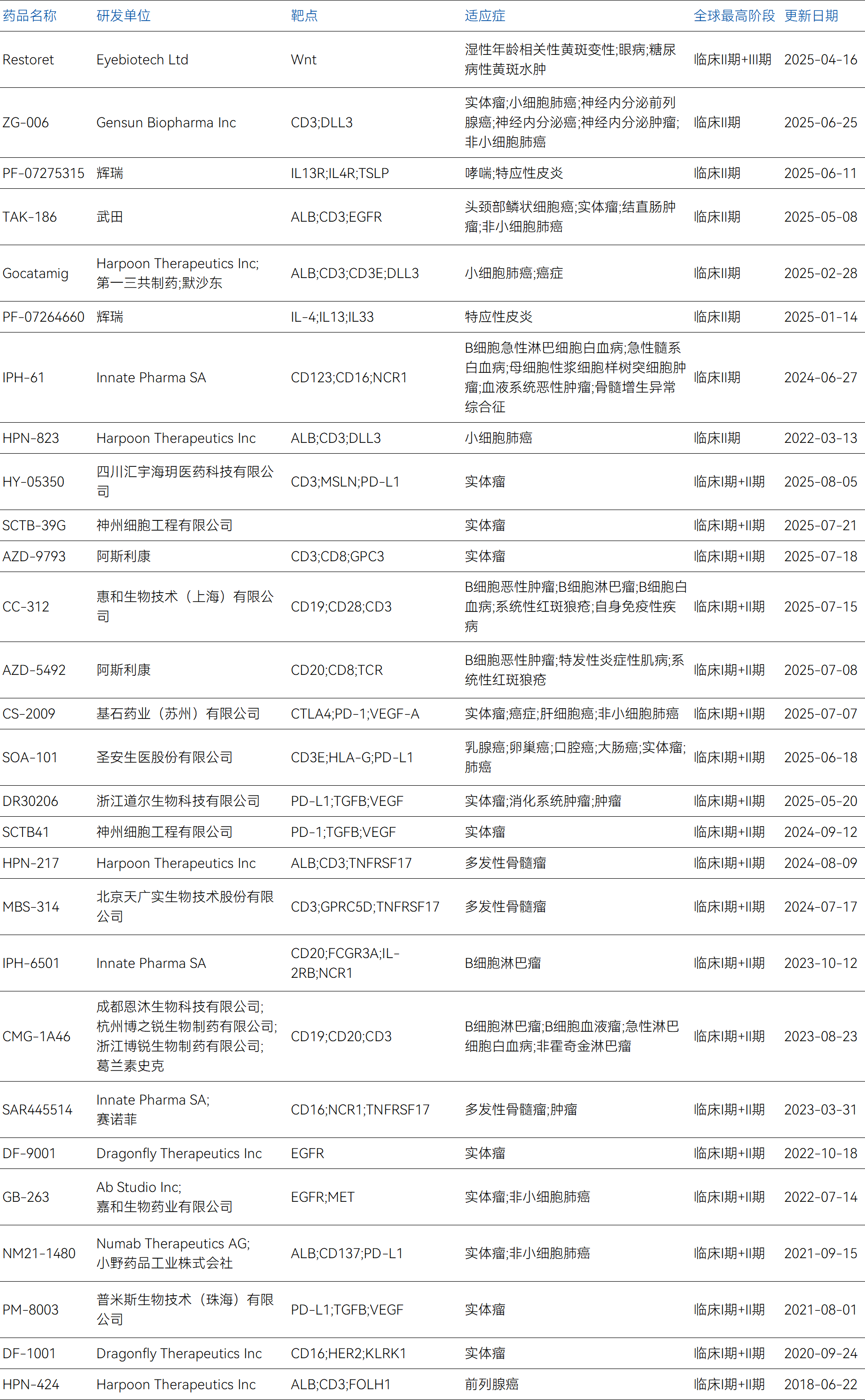
數據來源:藥智數據
研發者構成方面,三抗領域內呈現出大型跨國制藥公司與新興生物技術公司共同活躍的格局。強生、賽諾菲、輝瑞、阿斯利康、葛蘭素史克等跨國制藥巨頭憑借其雄厚的研發實力和豐富的臨床經驗,在技術平臺建設和復雜項目推進方面發揮著引領作用。同時,以恒瑞醫藥、百濟神州、康方生物、和鉑醫藥、宏成生物為代表的國內生物技術公司也展現出強勁的創新活力,它們往往在特定的技術路徑或適應癥選擇上具有獨特的優勢。
地域分布方面,當前臨床開發的三特異性抗體主要集中在中國和美國,報告指出中美兩國大約占據三抗全球70%左右的項目;歐洲(歐盟+英國)約占20%,其余項目由日本、澳大利亞和以色列等國承接,且中國在管線數量上的優勢更加明顯。

圖3:多特異性抗體專利統計顯示多特異性抗體專利近幾年井噴式增長。
圖源:筆者整理
至于中美領先的原因,前者主要得益于監管機構(NMPA)對創新抗體的快速審評,以及龐大的腫瘤患者基數提供臨床試驗市場;而后者則主要依賴于其成熟的創新藥生態系統與完善的融資環境。
靶點選擇策略方面,當前的三特異抗體設計主要圍繞幾個核心的靶點簇展開。其中最為主流的是以CD3為免疫效應細胞招募錨點,同時結合腫瘤特異性抗原如DLL3、GPRC5D、BCMA、EGFR、MSLN或CLDN18.2的組合設計。這種設計思路體現了將T細胞重定向與精準腫瘤識別相結合的治療理念。
與此同時,免疫檢查點的三聯組合(如PD-1/PD-L1/CTLA-4/TIGIT/LAG3/VEGF的不同搭配)以及NK細胞相關的三聯設計(如CD16×NCR1等組合)也在并行發展,反映出研發者們在免疫調節策略上的多元化探索。
適應癥分布方面,腫瘤治療占據了絕對主導地位,這與三特異抗體在免疫腫瘤學領域的技術優勢密切相關。血液腫瘤和實體瘤成為兩大核心應用場景,前者由于其相對均質的抗原表達和免疫微環境特點,往往成為新技術的首選驗證領域。值得注意的是,三特異抗體的應用范圍正在向腫瘤之外的領域擴展,包括炎癥性疾病、自身免疫疾病、感染性疾病(如HIV-1、SARS-CoV-2)以及眼科疾病,這種外延發展預示著該技術平臺具有更廣闊的治療潛力。
技術構型方面,多樣化是當前三特異抗體發展的另一個顯著特征。傳統的IgG×Fab×scFv格式之外,新興的設計如sdAb-scFv-sdAb、(Fab+Fab-Fab)-Fc等形式正在增多。特別值得關注的是條件性激活格式的興起,包括TRACTr、ProTriTAC以及基于掩蔽肽的設計等,這些創新格式旨在提高治療的精準性和安全性,通過在特定的腫瘤微環境條件下才激活抗體功能,從而減少對正常組織的影響。
2.MNC交易頻繁
近幾年以來,圍繞三抗的資本盛宴已然開席,三抗相關交易持續升溫。可以看到,下場的MNC越來越多。盡管這些管線仍處于早期階段,但也向外界傳遞著一個明確的信號,那就是,三抗已經徹底火起來了。
2025年1月,艾伯維與先聲再明達成GPRC5D/BCMA/CD3三抗SIM0500的10.55億美元合作,艾伯維在血液瘤領域的又一次出手。
2025年7月,艾伯維斥資7億美元預付款,總金額近20億美元引進IGI Therapeutics SA(IGI)公司的三特異性抗體新藥ISB 2001,獲得在北美、歐洲、日本和大中華區開發、制造和商業化的獨家權利。
2024年1月,默沙東以6.8億美元收購Harpoon Therapeutics,獲得DLL3/CD3/Albumin三抗HPN328(MK-6070)等一系列TCE產品。默沙東目前正在進行MK-6070用于小細胞肺癌的臨床Ⅱ期研究。
2024年10月,GSK以3億美元的首付款、5.5億美元的開發和商業化里程碑付款,從恩沐生物引進CD3/CD19/CD20三抗CMG1A46。
2024年3月,吉利德以5600萬美元預付款及最高15億美元里程碑付款,與Merus達成合作,聯手開發新型腫瘤相關抗原(TAA)的三抗。
3.MNC自研積極
當然,除了依靠BD模式快速擴充三抗在研管線外,MNC通常情況下也會不遺余力的推進“自研三抗”的落地。
部分MNC原研的三特異性抗體管線
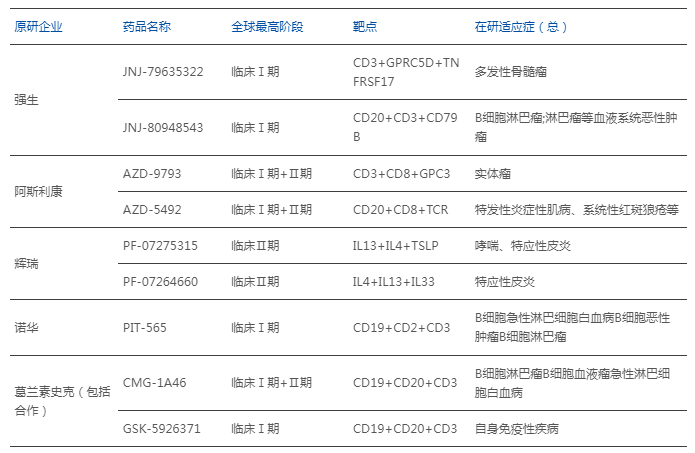
數據來源:藥智數據
強生的JNJ-5322,在2025年ASCO年會上首次披露相關臨床數據,以在未接受過BCMA/GPRC5D治療的RRMM患者中近100%的ORR數值,技驚四座,且在三藥耐藥的患者中,ORR高達86%,療效堪比CAR-T,有望成為下一代MM治療領域的有力競爭者。
阿斯利康開發的AZD5492是全球首款CD20/TCR/CD8三特異性抗體,該藥用于復發性或難治性B細胞惡性腫瘤和系統性紅斑狼瘡、特發性炎癥性肌病,均已進入臨床研究。阿斯利康另一款三抗藥物AZD9793(靶向GPC3/TCR/CD8)也已啟動1期臨床試驗,擬用于多種實體瘤。
輝瑞:已在炎癥免疫領域推進兩款三特異抗體,PF-07275315(IL-4/IL-13/TSLP)與PF-07264660(IL-4/IL-13/IL-33),均用于特應性皮炎,處于 II 期臨床;策略為“一針阻斷多條 II 型炎癥通路”,試圖在 Dupilumab 之外進一步降低復燃與難治人群負擔。
諾華:PIT565(CD19×CD3×CD2)為First-in-Class 三特 T 細胞連接器,依托 CD2 共刺激以緩解 T 細胞衰竭,用于復發/難治 B 細胞惡性腫瘤,I 期臨床進行中,已在 ASH 2023 發布研究設計與早期安全/藥理學信息。
GSK:GSK-5926371(CD19×CD20×CD3)定位于自身免疫性疾病,I 期管線已在官方管線報告披露;路徑為“低親和 CD3 牽引 + B 細胞雙靶去Plet化”,意在提升效力同時控制安全窗。GSK簡評:三家路線各有側重——輝瑞押注細胞因子軸并聯(皮膚免疫),諾華與GSK側重B細胞病理(血液/自身免疫)。與貴文“交易擴張并行自研落地”的判斷一致,且進一步說明三抗正由平臺化概念走向適應癥定制化工程。
三抗的挑戰與應對策略
從技術工程的角度來審視,我們正在見證多個獨立的創新領域的深度融合。條件性激活和掩蔽肽觸發機制讓抗體能夠像智能導彈一樣,只在到達預定目標區域后才"解除保險",而位點特異偶聯技術則確保了載荷藥物能夠精確地連接在抗體的指定位置上。
這種精密控制不僅能夠顯著擴大治療的安全窗口,還為臨床治療提供了更多的治療策略選擇,無論是采用序貫給藥的漸進式攻擊,還是選擇同步聯合的飽和式打擊。
當然,我們也必須誠實地面對這種技術融合帶來的新挑戰。如果把傳統單抗比作制造一把簡單而可靠的工具,那么三特異抗體就像是要制造一臺能夠同時執行三種不同任務的精密設備。這種復雜性的提升帶來了前所未有的技術挑戰。
首先是分子工程復雜性這一根本性挑戰,三特異抗體需要三條或更多蛋白鏈精確配對組裝,就像搭建一座需要多種零件完美契合的復雜建筑。與傳統抗體的對稱結構不同,這種不對稱分子極易產生錯誤配對,導致大量廢品。更麻煩的是,正確組裝的產物也常常表現出高度異質性,容易聚集,在治療濃度下黏度顯著增加,讓傳統制劑技術捉襟見肘。
其次是安全性風險的多重疊加,三特異抗體設計的初衷是強烈激活免疫細胞,但這把雙刃劍在殺傷腫瘤的同時也可能引發危險的細胞因子風暴,當與ADC聯用時,免疫激活的毒性與化療載荷的毒性相遇,就像兩股不同的風暴匯聚,可能產生比單獨出現時更嚴重的后果。
之后是來自藥代動力學特性的不理想,大多數三特異抗體半衰期較短,需要頻繁給藥或持續輸注。同時,復雜的分子結構和高疏水性表面讓制劑配方和給藥方式都面臨新的技術難題。
最后是適應癥選擇的現實局限。雖然在血液腫瘤中表現出色,但三特異抗體在實體瘤領域仍然舉步維艱。實體瘤缺乏理想的腫瘤特異抗原,存在顯著異質性,加上免疫抑制微環境的阻礙,讓理論優勢難以轉化為臨床價值。
面對這些系統性挑戰,全球制藥企業正在多個維度上展開創新攻關,形成了相互關聯而又各有側重的解決方案體系。
針對分子工程復雜性,各大企業主要通過先進的蛋白質工程技術來解決。比如賽諾菲的BEAT平臺、恒瑞與Ichnos的MATCH技術、廣泛應用的CrossMAb技術等,都是為了確保多鏈分子的正確配對。這些平臺就像為復雜設備設計的精密裝配線,通過特殊的"鎖扣"機制大大提高產物純度。定點偶聯技術更是將精確控制推向新高度,讓載荷藥物能夠精準連接到指定位置。
針對安全性挑戰,條件激活與掩蔽策略成為突破口。默沙東的ProTriTAC、Takeda的TRACTr、國內的COBRA平臺等,都采用在關鍵結合域前端添加可酶切掩蔽肽的策略。這種設計讓抗體像智能導彈一樣,只在到達腫瘤微環境后才"解除保險"。TwoGATE?技術則更加巧妙,將CD3結合位點分割為兩部分,只有當兩個抗體同時結合同一腫瘤細胞時才形成完整激活信號,實現了前所未有的精準控制。
針對藥代動力學不理想,企業通過制劑技術優化,篩選新型輔料、優化緩沖體系、降低分子疏水性等手段解決高黏度問題。透明質酸酶共制劑技術為皮下給藥開辟新途徑,蛋白結合域或Fc工程改造延長半衰期,一些企業還在探索延釋劑型開發,臨床策略的精細化管理已成為確保安全有效應用的關鍵。
當然,也正是基于對挑戰的深刻認識,業界在臨床開發策略上體現出應有的審慎智慧。分期序貫開發讓研究者充分評估風險收益,低劑量起始確保患者安全第一,基于生物標志物分層的精準醫學方法讓治療真正因人而異。這種漸進式概念驗證策略雖然可能延長開發周期,但為最終成功提供更堅實基礎。
通過這種系統性的挑戰分析和解決方案梳理,我們可以看到三特異抗體正在從"技術可行"向"臨床實用"轉變。跨國企業憑借強大平臺在復雜工程和安全管理方面引領,國內公司在獨特靶點組合和快速推進方面展現活力。隨著新技術平臺成熟和人工智能深度應用,三特異抗體有望逐步突破當前瓶頸,在更廣泛的癌癥治療中發揮價值。
三抗的未來方向
隨著三特異抗體技術日趨成熟,三特異性抗體的未來發展方向成為企業首要考慮的問題之一。當前研究重點正從基礎結構優化轉向臨床應用場景的深度挖掘,例如通過多靶點協同機制實現對復雜疾病(如腫瘤微環境調控、自身免疫性疾病)的精準干預。
而在技術路徑上,行業主要呈現三大趨勢:
技術迭代:很明顯,三抗絕非創新療法終點,未來一方面有望向著四特異性抗體演進,整合更多免疫調節信號(如IL-15、NKG2D),增強抗腫瘤效果及免疫應答持久性;另一方面則可能通過結構創新(如前藥設計、遮蔽肽技術)降低細胞因子釋放綜合征(CRS)等毒性風險,并優化生產工藝以解決多靶點抗體的復雜性難題。
適應癥擴展:就現階段三抗適應癥分布而言,血液腫瘤與實體瘤是最主要的適應癥范圍,但值得注意的是,三特異抗體的應用范圍正在向腫瘤之外的領域擴展,未來有望輻射至更多炎癥性疾病、自身免疫疾病、感染性疾病(如HIV-1、SARS-CoV-2)以及眼科疾病,這種外延發展預示著該技術平臺具有更廣闊的治療潛力。
聯合療法:與CAR-T、ADC(抗體偶聯藥物)、化療等聯用,克服單藥療效瓶頸,例如賽諾菲探索三抗+化療組合以提升耐藥性腫瘤的治療效果。
其中,聯合療法是目前三抗最有希望率先落地的方向之一,也是絕大多數藥企緊密推進的內容方向,尤其是“三抗+ADC”。
對于該聯合方案,三特異抗體就好比一位經驗豐富的偵察兵,它的任務是精準識別敵人的多個特征標志,同時呼叫友軍支援。而ADC技術則像是攜帶精確制導彈藥的轟炸機,專門負責對那些隱藏較深或防御較強的目標進行直接打擊。當這兩種力量協同作戰時,就能夠應對腫瘤細胞的各種狡猾策略,無論是抗原表達的變化、免疫微環境的"冷淡",還是傳統治療方法難以觸及的頑固病灶。
小結
當我們回望雙特異抗體十年來從實驗室走向臨床的征程,會發現這場變革的真正意義遠超技術本身——它重新定義了我們構建分子"橋梁"的思維方式。雙特異抗體教會了我們如何精準連接免疫細胞與腫瘤細胞,但面對癌癥的狡猾多變,我們很快意識到:僅僅復制成功是不夠的,我們需要讓這座橋梁變得更加智能和堅固。三特異抗體的興起標志著整個領域正在經歷一場深刻的轉變——從早期的"概念熱潮"轉向"證據驅動的精細競賽"。
這種轉變揭示了一個重要規律:當技術的門檻被普遍跨越后,真正的差異化就不再是"能做什么",而是"能做得多好"。成功的三特異抗體需要在靶點組合、信號工程和給藥策略三個維度上實現系統性卓越,而非簡單的分子復雜度堆砌。更引人深思的是產業生態的同步升級。如果說早期抗體開發還帶有"手工作坊"的色彩,那么今天的三特異抗體已經步入"精密制造"時代。
以博騰為代表的CDMO企業正從單純的"代工廠"蛻變為"技術合作伙伴",這種角色轉換提醒我們:在高度復雜的創新領域,成功需要整個生態系統的協同進化。最具前瞻性的開發者們正在踐行"階梯式技術演進"的智慧——先通過成熟的三特異技術建立安全基礎,再探索與ADC等先進技術的整合,始終以生物標志物為精準醫學的指南針。這種漸進式創新體現了對技術發展規律的深刻理解:真正的突破往往不是顛覆性的跳躍,而是在扎實基礎上的持續優化與智慧整合。
無論技術如何演進,競爭如何激烈,有一點永遠不應改變:一切創新的終極目標都是為患者創造更好的治療方案。當我們能夠將精巧的分子工程與深刻的患者需求洞察相結合時,才能創造出真正具有持久價值的醫療突破。這或許就是從雙特異到三特異這場技術進化最值得銘記的啟示。







